TITRASI: MENGUNGKAP RAHASIA DALAM SENI KIMIA

Oleh : Mariska Putri Amalia*
Titrasi adalah salah satu teknik penting dalam kimia analitik yang digunakan untuk menentukan konsentrasi suatu zat dalam suatu larutan. Teknik ini memanfaatkan reaksi kimia antara suatu zat yang diketahui konsentrasinya dengan zat yang ingin ditentukan konsentrasinya. Titrasi merupakan bagian integral dalam laboratorium kimia, dan pemahaman yang baik tentang prinsip-prinsip dasarnya sangat penting. Artikel ini akan membahas apa itu titrasi, langkah-langkahnya, serta perhitungan yang terlibat dalam proses ini.
Apa itu Titrasi?
Titrasi adalah proses kimia di mana kita menentukan konsentrasi suatu zat (analit) dalam suatu larutan dengan menggunakan zat lain yang disebut zat titrasi atau larutan titrasi. Titrasi melibatkan reaksi kimia antara analit dan titrasi yang diketahui konsentrasinya. Reaksi tersebut harus diketahui dengan baik sehingga dapat digunakan untuk mengukur jumlah zat yang dititrasi.
Langkah-langkah dalam Titrasi
Titrasi melibatkan beberapa langkah penting:
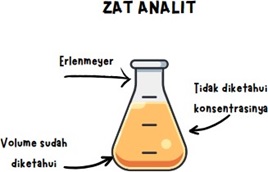 1. Persiapan Zat Analit : Zat analit merupakan zat kimia atau senyawa yang dianalisis atau diukur dalam suatu eksperimen atau proses analisis kimia. Dalam konteks titrasi zat analit adalah zat yang konsentrasinya belum diketahui atau yang akan diidentifikasi. Dalam laboratorium kimia, pemilihin zat analit sangat penting untuk mendapatkan hasil analisis yang akurat. Larutan yang mengandung zat analit perlu dipersiapkan dengan baik. Biasanya, ini melibatkan pengenceran sampel atau pengukuran berat sampel dalam kasus padatan.
1. Persiapan Zat Analit : Zat analit merupakan zat kimia atau senyawa yang dianalisis atau diukur dalam suatu eksperimen atau proses analisis kimia. Dalam konteks titrasi zat analit adalah zat yang konsentrasinya belum diketahui atau yang akan diidentifikasi. Dalam laboratorium kimia, pemilihin zat analit sangat penting untuk mendapatkan hasil analisis yang akurat. Larutan yang mengandung zat analit perlu dipersiapkan dengan baik. Biasanya, ini melibatkan pengenceran sampel atau pengukuran berat sampel dalam kasus padatan.
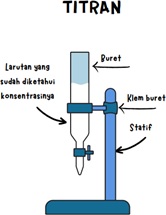 2. Persiapan Larutan Titrasi : Larutan titrasi yang diketahui konsentrasinya juga harus dipersiapkan. Pastikan konsentrasi larutan titrasi diketahui dengan akurat. Larutan ini harus direaksikan dengan analit untuk menentukan konsentrasi analit.
2. Persiapan Larutan Titrasi : Larutan titrasi yang diketahui konsentrasinya juga harus dipersiapkan. Pastikan konsentrasi larutan titrasi diketahui dengan akurat. Larutan ini harus direaksikan dengan analit untuk menentukan konsentrasi analit.
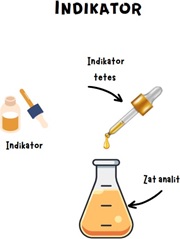 3. Penambahan Indikator : Indikator adalah senyawa kimia yang ditambahkan ke dalam larutan yang akan dititrasi (zat analit). Dalam beberapa kasus, indikator kimia ditambahkan ke larutan analit. Perubahan warna ini memberikan petunjuk kepada analis bahwa reaksi titrasi telah mencapai titik akhir ayau titik ekivalen, di mana reaksi antara zat analit dan zat titran telah selesai. Pemilihan indikator sangat penting dalam titrasi karena indikator yang tepat akan memberikan hasil yang akurat.
3. Penambahan Indikator : Indikator adalah senyawa kimia yang ditambahkan ke dalam larutan yang akan dititrasi (zat analit). Dalam beberapa kasus, indikator kimia ditambahkan ke larutan analit. Perubahan warna ini memberikan petunjuk kepada analis bahwa reaksi titrasi telah mencapai titik akhir ayau titik ekivalen, di mana reaksi antara zat analit dan zat titran telah selesai. Pemilihan indikator sangat penting dalam titrasi karena indikator yang tepat akan memberikan hasil yang akurat.
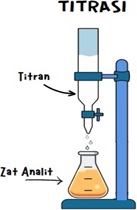 4. Pelaksanaan Titrasi : Proses praktis di laboratorium kimia dimana larutan titrasi ditambahkan ke larutan analit dalam jumlah yang tepat. Reaksi kimia antara keduanya akan terjadi. Tujuan titrasi adalah mengukur konsentrasi suatu senyawa dalam suatu sampel dengan menggunakan larutan standar yang telah diketahui konsentrasinya.
4. Pelaksanaan Titrasi : Proses praktis di laboratorium kimia dimana larutan titrasi ditambahkan ke larutan analit dalam jumlah yang tepat. Reaksi kimia antara keduanya akan terjadi. Tujuan titrasi adalah mengukur konsentrasi suatu senyawa dalam suatu sampel dengan menggunakan larutan standar yang telah diketahui konsentrasinya.
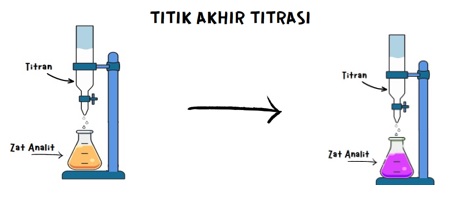 5. Titik Akhir : Pada titik tertentu, jumlah larutan titrasi yang ditambahkan cukup untuk mencapai titik akhir reaksi. Ini dapat ditentukan dengan perubahan warna indikator atau menggunakan metode lain, seperti penggunaan elektroda pH.
5. Titik Akhir : Pada titik tertentu, jumlah larutan titrasi yang ditambahkan cukup untuk mencapai titik akhir reaksi. Ini dapat ditentukan dengan perubahan warna indikator atau menggunakan metode lain, seperti penggunaan elektroda pH.
Perhitungan dalam Titrasi
Setelah titrasi selesai, perlu dilakukan perhitungan untuk menentukan konsentrasi zat analit.Beberapa perhitungan yang umum dilakukan dalam titrasi antara lain:
1. Perhitungan Normalitas : Normalitas adalah ukuran konsentrasi suatu larutan yang mempertimbangkan jumlah ekivalen dari zat terlarut dalam satu liter larutan. Normalitas biasanya dilambangkan dengan symbol “N”. jumlah ekivalen mengacu pada jumlah ion aktif atau atom dalam satu molekul zat terlarut yang berpartisipasi dalam reaksi kimia. Normalitas memberikan informasi tentang kekuatan reaktif dari suatu larutan dalam suatu reaksi kimia.
Normalitas dapat dihitung dengan rumus berikut:

Dimana :
• N adalah normalitas dalam ekivalen per liter (eq/L atau N).
• Berat molar A adalah berat molar zat A dalam g/mol.
• x adalah jumlah ekivalen zat A yang bereaksi dengan x ekivalen zat B.
• konsentrasi B adalah konsentrasi zat B dalam mol/L.
• V adalah volume larutan dalam liter (L)
2. Perhitungan Molaritas : molaritas adalah metode ukuran konsentrasi suatu larutan dalam kimia. Ia mengukur jumlah mol zat terlarut dalam satu liter larutan. Molaritas biasanya dilambangkan dengan simbol “M” dan dihitung dengan rumus:

Dimana :
• M adalah molaritas dalam mol/L (mol per liter).
• Bobot adalah berat zat terlarut dalam gram (g).
• Berat Molar adalah berat molar zat tertentu dalam gram/mol (g/mol).
• Volume adalah volume larutan dalam liter (L).
3. Perhitungan Konsentrasi : Konsentrasi zat analit dihitung dengan menggunakan prinsip stoikiometri dari reaksi antara analit dan titrasi. Misalnya, jika Anda menggunakan larutan titrasi HCl untuk menentukan konsentrasi larutan NaOH, Anda
Akan menggunakan persamaan stoikiometri berdasarkan reaksi kimia yang terjadi: HCl
+ NaOH -> NaCl + H2O.Dengan mengukur volume larutan titrasi yang digunakan hingga mencapai titik akhir, Anda dapat menghitung konsentrasi NaOH.
Dalam titrasi asam-basa, persamaan umunya adalah nA⋅VA = nB⋅VB. Dimana:
• nA adalah jumlah mol zat terlarut dalam sampel (atau larutan standar A).
• VA adalah volume larutan sampel (atau larutan standar A) yang digunakan dalam titrasi, diukur dalam liter.
• nB adalah jumlah mol zat terlarut dalam larutan standar B (larutan titran).
• VB adalah volume larutan standar B (larutan titran) yang digunakan dalam titrasi, diukur dalam liter.
Kesimpulan
Titrasi adalah alat penting dalam kimia analitik yang memungkinkan kita untuk menentukan konsentrasi zat dalam larutan dengan akurasi tinggi. Untuk berhasil melakukan titrasi, penting untuk memahami prinsip dasar, langkah-langkah, dan perhitungan yang terlibat dalam proses ini. Dengan pemahaman yang baik tentang titrasi, kita dapat mengungkap rahasia dalam seni kimia ini dan mendapatkan data yang diperlukan untuk berbagai aplikasi dalam ilmu pengetahuan dan industri.***
*Penulis adalah Mahasiswa Prodi Teknik Kimia Universitas Pamulang






